Santé 2 : Les molécules
I) Le modèle moléculaire
1) Qu'est-ce qu'une molécule ?
Une molécule est un ensemble d'atomes liés entre eux. Les molécules sont électriquement neutres.
2) Modélisation des atomes et des molécules
On définit un atome par son nom et son symbole. De la même manière, on définit une molécule par son nom est sa formule brute.
Exemple : Hydrogène (nom), H (symbole)
L'eau (nom), H2O (formule brute)
Les chimistes ont créé des modèles moléculaires pour représenter des molécules. Les atomes sont ainsi représentés par des boules de couleurs : noire pour le carbone, blanche pour l'hydrogène, rouge pour l'oxygène et bleue pour l'azote
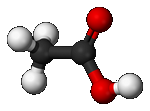
3) Les liaisons entre les atomes
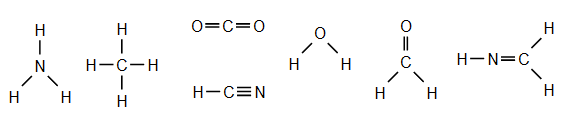
Il existe troi types de liaisons :
- les liaisons simples :  (dihydrogène) ;
(dihydrogène) ;
- les liaisons doubles :  (dioxygène) ;
(dioxygène) ;
- les liaisons triples :  (diazote).
(diazote).
Les atomes doivent former un nombre de liaisons défini :
- quatre liaisons pour le carbone ;
- trois liaisons pour l'azote ;
- deux liaisons pour l'oxygène ;
- une liaison pour l'hydrogène.
Les liaisons doubles comptent pour deux et les liaisons triples comptent pour trois.
Exemple :
II) Représentation des molécules
1) Formule développée et semi-développée
a) Formule développée
On représente les symboles des atomes et toutes les liaisons.
Exemple :

Formule développée de l'éthanol.
b) Formule semi-développée
On ne représente pas les liaisons avec l'hydrogène.
Exemple :
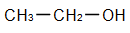
Formule semi-développée de l'éthanol.
2) Notion d'isomérie
On appelle isomères des espèces chimiques qui ont la même formule brute mais des formules
développées ou semi-développées différentes.
Les isomères sont en réalité des espèces chimiques différentes qui ont des propriétés physiques et chimiques différentes.
Exemple :

II) Les mélanges dans les médicaments
1) Différences entre corps pur et mélange
Bilan du chapitre
-