Univers 5 : Les éléments chimiques
I) Qu'est-ce qu'un élément chimique ?
1) Caractérisation
Un élément chimique est caractérisé par son nombre de protons Z.
Dans une réaction chimique, les noyaux ne sont pas modifiés, les atomes ne changent donc pas. Il y a
conservation des éléments. Un élément ne peut ni disparaître ni apparaître.
Exemple : les différentes formes de l'élément cuivre
Cu cuivre solide, Cu2+ ions cuivre II, Cu(OH)2 hydroxyde de cuivre II (dans un solide cristallin), etc...
2) Notation symbolique
Un atome de symbole chimique X, dont le noyau possède A nucléons et Z protons est noté  .
.
Exemple : hydrogène 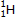 , carbone
, carbone 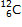 , cuivre
, cuivre 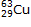 .
.
II) Isotope
Des atomes isotopes ont le même nombre de protons mais des nombre de neutrons différents. Ainsi, ils
ont le même numéro atomique Z mais des nombre de nucléons A différents. Les ions aussi peuvent être
isotopes.
Exemple : le carbone 12 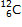 et le carbone 14
et le carbone 14 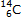 sont des atomes isotopes, ils possèdent le même nombre
de protons Z = 6 mais le carbone 12 possède A = 12 nucléons donc 6 neutrons, alors que le carbone 14
possède A = 14 nucléons donc 8 neutrons.
sont des atomes isotopes, ils possèdent le même nombre
de protons Z = 6 mais le carbone 12 possède A = 12 nucléons donc 6 neutrons, alors que le carbone 14
possède A = 14 nucléons donc 8 neutrons.
III) Les structures stables de la matière
1) Répartition des électrons
Les électrons d'un atome ou d'un ion se répartissent en couches électroniques. La couche la plus proche du noyau est notée K (Kern = noyau en allemand)
puis les autres suivent l'ordre alphabétique : L, M, etc.
Chaque couche électronique ne peut contenir qu'un nombre limité d'électrons :
K 2 électrons
L 8 électrons
M 18 électrons
(N, O et P 32 électrons)
Lorsqu'une couche contient son nombre maximal d'électrons, on dit qu'elle est saturée. La dernière couche
occupée est appelée couche externe.
Les électrons se répartissent sur les couches l'une après l'autre : d'abord K, puis L quand K est saturée, puis
M quand L est saturée, etc...Cette répartition correspond à l'état le plus stable de l'atome ou de l'ion, on
l'appelle état fondamental.
Exemple :

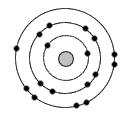
Pour représenter la répartition des électrons sur les couches électroniques on donne la formule
électronique.
Exemple :
hydrogène H : K1
carbone C : K2L4
chlore Cl : K2L8M7
2) Règle du duet et de l'octet
Dans l'Univers, la plupart des atomes des éléments chimiques s'assemblent pour former des molécules, des
cristaux, etc... seuls les éléments tels que l'hélium, l'argon, le néon, . existent à l'état atomique : ils sont
appelés gaz nobles. Ils sont à l'état gazeux et ne réagissent avec quasiment aucune espèce.
Cette stabilité est due au fait que leur couche externe contient un nombre d'électrons particulier, soit 2 pour l'hélium
(règle du duet) et 8 pour les autres (règle de l'octet).
hélium He : K2
néon Ne : K2L8
argon Ar : K2L8M8
Les autres atomes tendent à atteindre ces structures életroniques en se changeant en ion.
Exemple :
Li (Z=3) : K2L1 devient Li+ : K2
O (Z=8) : K2L6 devient O2- : K2L8
Bilan du chapitre
- Je connais la signification du symbole de l'atome.
- Je connais le symbole de quelques éléments chimiques.
- Je sais que le numéro atomique caractérise l'élément chmique.
- Je connais les règles du duet et de l'octet.