Chapitre C3 : Attaque d'un métal par un acide
I) Les solutions acides
Toutes les solutions aqueuses contiennent des ions hydrogène H+ et des ions hydroxyde HO-.
Une solution est dite « neutre » lorsqu’elle contient autant d’ions H+ que d’ions HO-.
Une solution est dite « acide » lorsqu’elle contient plus d’ions H+ que d’ions HO-.
Une solution est dite « basique » lorsqu’elle contient moins d’ions H+ que d’ions HO-.
Le taux d’acidité d’une solution est appelé « pH ». On peut mesurer le pH d’une solution grâce à du papier
pH, ou à un pH-mètre.
On détermine l’échelle de pH :
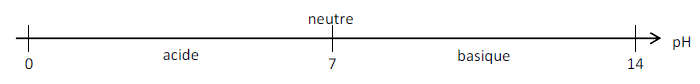
Lorsqu’on dilue une solution acide, son pH augmente au maximum jusqu’à 7.
Lorsqu’on dilue une solution basique, son pH diminue au minimum jusqu’à 7.
 Attention
Attention 
Les acides et les bases sont des solutions concentrées : elles sont corrosives. Le contact avec ces solutions
peut provoquer de graves brûlures. Il faut toujours manipuler les solutions acides ou basiques avec des
gants, une blouse et des lunettes.
II) Tests de reconnaissance
Les ions présents dans les solutions aqueuses peuvent réagir entre eux et former des solides en suspension
dans la solution, appelés « précipités ».
Voici quelques tests de reconnaissance qui seront utiles en classe de troisième :
| Ion négatif | Ion positif | Couleur du précipité | Formule |
|---|---|---|---|
| Hydroxyde HO- | Cuivre Cu2+ | bleu | Cu(OH)2 |
| Hydroxyde HO- | Fer (II) Fe2+ | vert | Fe(OH)2 |
| Hydroxyde HO- | Fer (III) Fe3+ | rouge | Fe(OH)3 |
| Chlorure Cl- | Argent Ag+ | blanc qui noircit à la lumière | AgCl |
III) Réaction entre l'acide chlorhydrique et le fer
L'acide chlorhydrique est une solution d'acide concentrée ( ) contenant des ions hydrogène H+
et chlorure Cl-.
) contenant des ions hydrogène H+
et chlorure Cl-.
Le bilan de la réaction est :
acide chlorhydrique + fer -> dihydrogène + ions fer (II)
Equation-bilan :
2 H+ + Fe -> H2 + Fe2+
On voit que les ions chlorure ne participent pas à la réaction : ce sont des ions « spectateurs ».